
团结 自强 敬业 创新
遵义医科大学附属医院.公益
UEGW 2024 | 遵义医科大学附属医院庹必光/刘雪梅教授团队:聚焦胃黏膜损伤疾病发病机制研究
第三十二届欧洲消化疾病周(UEG Week 2024)于2024年10月12日至15日在奥地利维也纳成功举行。遵义医科大学附属医院消化内科庹必光、刘雪梅教授团队的两项研究成果成功入选会议的Moderated Poster,再次展现了该团队在消化系统疾病研究领域的深厚积淀。欧洲消化疾病周(UEG Week)是全球消化系统疾病领域最具影响力和权威性的学术会议之一,每年吸引来自世界各地的顶尖专家、学者、研究人员和临床医生齐聚一堂。会议涵盖了从基础研究到临床应用的广泛主题,包括胃肠道、肝胆胰、内镜和外科等多个消化领域的前沿进展与创新技术。作为全球消化病学领域的风向标,UEG Week 为与会者提供了展示最新研究成果、分享临床经验、探讨未来发展方向的宝贵平台,不仅推动了全球消化医学的发展,还为改善患者治疗方案与预后提供了重要参考和支持。
既往关于黏膜损伤性疾病的研究多关注黏膜损害因素的增加,比如幽门螺旋杆菌感染、酒精和药物等。然而从黏膜保护屏障削弱角度的研究相对较少。遵义医科大学附属医院消化内科庹必光、刘雪梅教授团队多年来深耕离子通道与消化系统肿瘤及癌前病变的研究,关注胃肠黏膜屏障保护及免疫调控机制,从黏膜保护减弱角度切入,探寻黏膜损伤性疾病发生机制科学难题。团队两项研究成果均被接收为大会口头壁报。
Moderated Poster 1:Slc26a9调控胃壁细胞功能并在损伤诱导的胃黏膜化生中发挥重要保护作用(Abstract: AS-UEG-2024-01402)
主要完成人:遵义医科大学附属医院消化内科 巫恩琴,邓梓琳,马志远,庹必光,刘雪梅
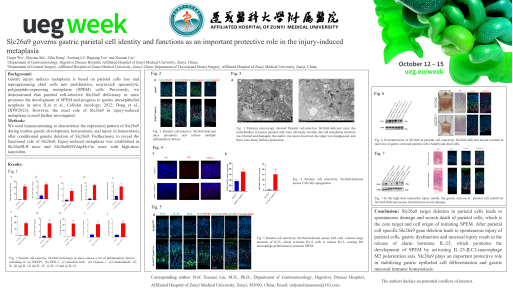
胃黏膜损伤诱导的化生是基于壁细胞丢失和将主细胞重编程为增殖性、富含黏蛋白的解痉多肽表达型化生(SPEM)细胞。Slc26a9是胃壁细胞上高表达的氯离子通道,参与维持壁细胞存活与功能。我们以往发现壁细胞特异性 Slc26a9 缺乏会促进小鼠胃黏膜 SPEM 的发生并进展为胃黏膜上皮内瘤变 (Liu et al., Cellular oncology, 2022; Deng et al., DDW 2023; Wu et al., DDW 2024)。然而,Slc26a9 在胃黏膜损伤诱导化生中的作用仍不清楚。
该研究聚焦氯离子通道Slc26a9与胃黏膜损伤诱导的化生,团队成功构建了胃壁细胞特异性Slc26a9基因敲除小鼠模型(Slc26a9fl/fl/Atp4b-Cre),与对照组(Slc26a9fl/fl)小鼠相比,Slc26a9fl/fl/Atp4b-Cre小鼠可发生自身免疫性萎缩性胃炎和SPEM,并伴有壁细胞焦亡和丢失。另外,壁细胞Slc26a9缺乏可以诱导高胃泌素血症和M2巨噬细胞极化。团队利用腺相关病毒携带Slc26a9片段来感染壁细胞特异性Slc26a9缺乏小鼠的胃黏膜进而恢复Slc26a9表达,发现壁细胞和主细胞的丢失被恢复。相反,高剂量他莫昔芬可以诱导壁细胞特异性Slc26a9基因敲除小鼠更严重的胃黏膜损伤。因此,壁细胞特异性Slc26a9缺乏可以通过激活M2巨噬细胞极化轴来诱导胃黏膜SPEM的发生,并且Slc26a9缺乏可以促进更严重的胃黏膜损伤。所以,以上数据提示Slc26a9在胃黏膜损伤诱导的化生中扮演重要的调控作用,为胃黏膜稳态及保护机制提供新靶点。
Moderated Poster 2:胃主细胞特异性CHIA缺乏通过诱导主细胞焦亡介导的M2巨噬细胞极化来促进胃黏膜解痉多肽表达型化生 (SPEM)(Abstract: AS-UEG-2024-01291)
主要完成人:遵义医科大学附属医院消化内科 刘书慧,赵荧荧,马志远,庹必光,刘雪梅
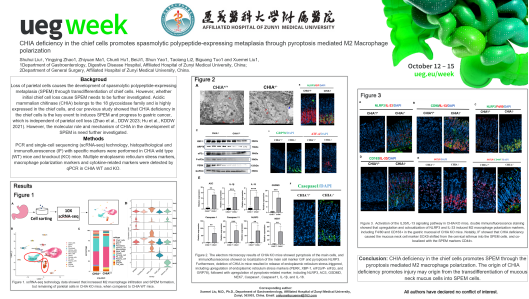
既往研究显示,各种原因导致的壁细胞缺失是发生SPEM的首要条件,在此过程中,主细胞的缺失或转分化被认为是基于壁细胞缺失的继发现象。然而,近期研究表明,主细胞的初始缺失同样可以诱导SPEM的发生。在DDW2023和DDW2024会议上,刘雪梅教授团队创新性地探讨了SPEM的全新起源,首次发现主细胞CHIA基因缺失导致的主细胞初始缺失,是引发SPEM的重要事件,且与壁细胞的缺失无关。
在这个研究中,我们运用主细胞特异性CHIA缺失小鼠模型(CHIArox/rox-GIF-Dre),发现主细胞特异性CHIA 缺乏是诱发 SPEM 并进展为胃癌的关键事件,这与壁细胞缺失无关(Liu et al., DDW2024; Zhao et al., DDW 2023; Hu et al., KDDW 2021)。另外,我们发现胃黏膜主细胞特异性CHIA缺失诱导主细胞焦亡(主细胞标志物Mist-1表达缺失,焦亡标志物NLRP3、ACS、GSDMD、NEK7、Caspase1、Caspase11、IL-1β和IL-18表达增高)、内质网应激(标志物PERK、XBP-1、eIF2α/P- eIF2α和GRP78表达增加)和M2 巨噬细胞极化(标志物F4/80和CD163+表达增加)的发生。此外,在主细胞特异性 CHIA 基因敲除小鼠中,粘液颈细胞特异性标志物 SOX9 从胃体峡部迁移至胃底表达,并与 SPEM 标志物 CD44v9 共定位。因此,主细胞特异性 CHIA 缺乏通过诱导主细胞焦亡介导的 M2 巨噬细胞极化促进胃黏膜 SPEM的发生。主细胞特异性 CHIA缺乏导致损伤的根源可能在于粘液颈细胞向SPEM细胞的转分化。
该研究首次聚焦主细胞初始缺失与SPEM的发生,表明主细胞特异性 CHIA 缺乏通过诱导主细胞焦亡介导的 M2 巨噬细胞极化促进胃黏膜 SPEM的发生,这一过程独立于壁细胞缺失,为胃黏膜恶性损伤性疾病的防治提供了新的方向。
3. 本次会议上世界内镜组织(WEO)胃十二指肠委员会正式成立,日本东京大学藤城光弘教授任主席,刘雪梅教授当选为委员,并线上讨论参与制定国际共识意见“AI possition statement for early gastric cancer diagnosis (WEO)”
此次欧洲UEG Week 2024,庹必光/刘雪梅教授团队向世界展示了离子通道在胃黏膜损伤疾病中的新理念,提出了新的离子通道Slc26a9在调节胃黏膜防御屏障和胃黏膜损伤诱导的化生中的新方向。同时,还提出了主细胞特异性CHIA缺失诱导主细胞初始缺失是触发SPEM发生的关键事件的新视点。遵义医科大学附属医院消化团队的研究不断在国际舞台上收获国际关注,并在国际权威学术组织(世界内镜组织WEO)任学术兼职,参与国际学术指南制订,发出中国消化声音,提升学科国际影响力,促进学科高质量发展。
主要研究者简介

庹必光 教授
遵义医科大学附属医院消化内科学科带头人,二级教授
德国汉诺威医科大学医学博士
美国圣地亚哥加利福尼亚大学访问学者
中华医学会消化病学分会常委
贵州省医学会消化病学分会主任委员
贵州省消化内科专业医疗质量控制中心主任委员
贵州省消化疾病研究所所长
贵州省消化系统疾病临床研究中心主任
中华医学会消化病学分会心身协作组组长
2015年贵州省科技进步一等奖获得者

刘雪梅 教授
遵义医科大学附属医院消化内科主任,教授/主任医师、博士研究生导师
德国汉诺威医科大学医学博士、博士后,日本新泻大学高级访问学者
中华医学会消化病学分会青年学组副组长
中华医学会消化病学分会胃肠激素与神经内分泌肿瘤(黏膜屏障)学组副组长
中国抗癌协会神经内分泌肿瘤专委会常委
中国医师协会内镜医师分会专委会委员
中国罕见病联盟消化专委会委员兼秘书长
海医会消化内镜分会 常委
贵州省医学会消化病学分会副主任委员
贵州省消化内科专业医疗质量控制中心副主任委员
贵州省自然科学一等奖获得者、贵州省省管专家
遵义医科大学附属医院党委宣传部
审核:肖毅
编辑:张洁
整理:吴双双